Повышение фотокаталитической активности Хлорида Серебра-AgCl в видимом свете с помощью модификации Ацетата Церия (III)-CeO₂ для разложения нескольких органических загрязнителей
Новый тип катализатора CeO₂-модифицированного AgCl (CeO₂/AgCl) был получен одностадийным методом, эффективно подавляющим рекомбинацию фотогенерированных носителей заряда. В процессе разложения загрязнителей под действием видимого света данный катализатор продемонстрировал отличную и стабильную производительность. Он не только эффективно разлагал родамин B (RhB), метиловый оранжевый (MO) и кристаллический фиолетовый (CV), но и сохранял высокую активность в различных условиях окружающей среды. Особенно в эксперименте по разложению RhB композит CeO₂/AgCl-30 с оптимальным соотношением компонентов показал скорость разложения в 5,43 раза выше, чем у чистого AgCl в морской воде, и в 9,17 раза выше — в условиях с использованием деионизированной воды, при этом сохраняя отличную стабильность. С помощью методов характеристизации, таких как XRD, XPS и ЭПР, были проанализированы его кристаллическая структура, элементный состав и другие свойства. На основании результатов анализов было установлено, что композит CeO₂/AgCl обладает относительно широким диапазоном светопоглощения и высокой эффективностью разделения фотогенерированных зарядов. Кроме того, было установлено, что основными активными видами в процессе реакции являются супероксидные радикалы (·O₂⁻) и гидроксильные радикалы (·OH). Наконец, на основе энергетической зонной структуры была предложена S-схема гетероструктуры перехода.
1. Введение
С ускорением темпов индустриализации проблема загрязнения окружающей среды становится всё более острой. В частности, органические загрязнители, являясь типичным источником загрязнений, отличаются сложным составом, высокой окрашенностью, токсичностью и трудностью в биологическом разложении. Их массовое накопление в водной среде и атмосфере представляет серьёзную угрозу для экосистем и здоровья человека. Среди них родамин B (RhB), кристаллический фиолетовый (CV), метиловый оранжевый (MO) и другие органические красители широко применяются в таких отраслях, как текстильная, печатная и кожевенная промышленность, и сбрасываются в водоёмы в больших объёмах, вызывая серьёзное загрязнение окружающей среды.
Традиционные методы очистки сточных вод, такие как биологическая обработка, физическая адсорбция и химическая осаждение, при обработке сточных вод, содержащих органические красители, часто сталкиваются с рядом проблем: низкая эффективность очистки, высокая стоимость или склонность к образованию вторичного загрязнения.
Фотокаталитическая технология, как многообещающий «зелёный» и экологически чистый метод очистки, обладает высоким потенциалом применения благодаря таким преимуществам, как низкое энергопотребление, мягкие условия реакции и способность полностью минерализовать органические загрязнители до углекислого газа и воды [1,2].
Фотокатализаторы могут использовать энергию света для генерации активных частиц с высокой окислительной способностью, таких как электронно-дырочные пары и гидроксильные радикалы. Эти активные частицы могут полностью разрушать органические загрязнители, превращая их в безвредные CO₂ и воду [3,4].
Среди множества фотокаталитических материалов галоиды серебра (AgX, где X = Cl, Br, I) обладают определённой фотокаталитической активностью благодаря своим уникальным оптическим и электронным свойствам [5]. Хлорид серебра (AgCl) имеет подходящую ширину запрещённой зоны и может поглощать видимый свет, что делает возможным использование солнечной энергии [6,7]. Однако у чистого AgCl есть определённые ограничения в практическом применении. Например, скорость рекомбинации фотогенерированных носителей заряда довольно высока, что ограничивает его фотокаталитическую эффективность. Также у него слабая стабильность, и он склонен к фотокоррозии при длительном освещении [8,9,10].
CeO₂, как важный оксид редкоземельного элемента, обладает отличной способностью к хранению и высвобождению кислорода, переменными степенями окисления и хорошей электропроводностью [11,12,13]. Комбинация CeO₂ с AgCl в оптимальном соотношении может привести к созданию нового высокоэффективного композитного фотокаталитического материала, который эффективно подавляет рекомбинацию носителей заряда, генерируемых светом в AgCl, и увеличивает их время жизни, тем самым повышая квантовый выход фотокаталитических реакций. Кроме того, структурные особенности самого CeO₂ могут повысить стабильность композита и снизить фотокоррозию AgCl [8,14].
Учитывая вышеизложенное, в данном исследовании была поставлена задача синтеза композита CeO₂/AgCl , построения S-схемной гетероструктуры и углубленного изучения его фотокаталитической активности в процессе разложения органических красителей в различных средах. Также проведён глубокий анализ механизма действия сформированной гетероструктуры, что обеспечивает теоретическую и техническую основу для разработки эффективных, стабильных и практичных фотокаталитических систем. Цель — предложить новые идеи и стратегии для создания эффективных и устойчивых фотокаталитических материалов и содействовать дальнейшему развитию фотокатализа в области очистки окружающей среды.
2. Эксперименты
2.1. Приготовление CeO₂
Растворите 7,2 г NaOH в 20 мл деионизированной воды. Полученный раствор обозначьте как Раствор A и отложите для последующего использования. Затем растворите 2,21 г Ce(NO₃)₃·6H₂O в 30 мл деионизированной воды. После того как раствор станет однородным, медленно добавляйте Раствор A капля за каплей при постоянном перемешивании и продолжайте перемешивание в течение 30 минут. Затем подвергните полученную смесь гидротермальной обработке при температуре 100 °C в течение 24 часов. По завершении синтеза промойте полученный продукт чередующимися промывками водой и этанолом, после чего высушите при температуре 100 °C на протяжении ночи. Наконец, поместите высушенный образец в муфельную печь и прокалите его при 600 °C в течение 2 часов для получения CeO₂.
2.2. Синтез фотокатализатора CeO₂/AgCl
Растворите 1,18 г AgNO₃ в 30 мл деионизированной воды. Затем добавьте определённое количество CeO₂ и перемешивайте в течение 1 часа. После этого добавьте 3 мл 36%-ной соляной кислоты и продолжайте перемешивание в тёмном месте в течение 3 часов. В завершение промойте полученный образец чередующимися промывками водой и этанолом, затем высушите его в сушильном шкафу при 60 °C в течение ночи. Полученные образцы обозначаются как CeO₂/AgCl .
Массы добавленного CeO₂ составляют 0,1 г, 0,3 г и 0,5 г; соответствующие обозначения образцов: CeO₂/AgCl -10, CeO₂/AgCl -30 и CeO₂/AgCl -50. Для получения чистого AgCl используется та же процедура, за исключением того, что CeO₂ не добавляется.
3. Результаты и обсуждение
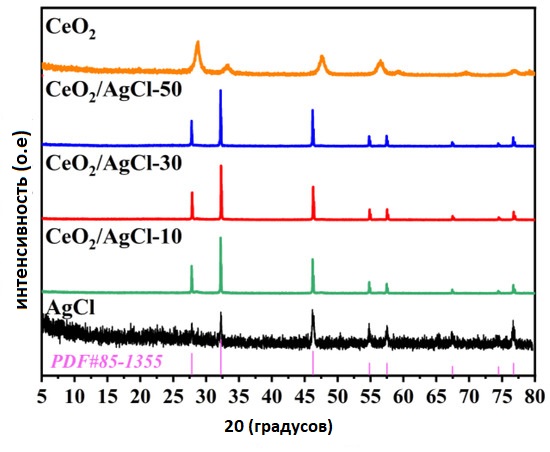
На Рисунке 1 представлены результаты рентгеноструктурного анализа (XRD) для образцов CeO₂, AgCl и композитов CeO₂/AgCl с различными соотношениями компонентов. Из рисунка чётко видно, что как композитные материалы CeO₂/AgCl , так и чистый AgCl обладают относительно узкой шириной на полувысоте дифракционных пиков, что указывает на хорошую кристалличность материала [15].
Дифракционные пики при 27.8°, 32.2°, 46.2°, 54.8°, 57.5°, 67.5°, 74.5°, 76.8° и 85.7° соответствуют кристаллографическим плоскостям (111), (200), (220), (311), (222), (400), (331), (420) и (422) AgCl и хорошо согласуются со стандартной XRD-картой AgCl (JCPDS №85-1355) [16].
Также можно заметить, что после добавления CeO₂ в материал, позиции и интенсивности дифракционных пиков остаются практически неизменными, что говорит о том, что кристаллическая структура AgCl остаётся стабильной [17].
Следует отметить, что XRD-сигнал чистого AgCl имеет относительно высокий уровень шума, что может быть связано с большим размером частиц в образце AgCl , полученном отдельно, а также с возможными явлениями агломерации.
ИК-спектры (FTIR) данных материалов приведены на Рисунке S1. Можно увидеть, что по сравнению с AgCl , CeO₂ демонстрирует явный пик поглощения в области 500–600 см⁻¹, обусловленный колебаниями связи Ce–O [18]. В композите CeO₂/AgCl также чётко выражены пики в диапазоне 500–600 см⁻¹, что дополнительно подтверждает успешное внедрение CeO₂ в состав композита.
Рисунок 1. Рентгенодифрактограммы (XRD) AgCl , CeO₂ и композитов с различными соотношениями компонентов.
Для изучения изменений в химических состояниях различных элементов в материалах была проведена рентгенофотоэлектронная спектроскопия (XPS) для образцов AgCl , CeO₂ и CeO₂/AgCl -30. На Рисунке 2 представлены спектры четырех элементов: Ag, Cl, O и Ce.
- Рисунок 2А: спектр Ag 3d. Характеристические пики на 366,7 эВ и 372,7 эВ соответствуют орбиталям Ag⁺ 3d₅/₂ и Ag⁺ 3d₃/₂ [19]. В случае композита CeO₂/AgCl -30 аналогичные пики наблюдаются на 367,2 эВ и 373,2 эВ соответственно.
- Рисунок 2B: два характерных пика для Cl⁻ в AgCl — 197,0 эВ (Cl 2p₁/₂) и 198,6 эВ (Cl 2p₃/₂) [20]. В CeO₂/AgCl -30 эти пики смещаются на 197,6 эВ и 199,2 эВ соответственно.
Стоит отметить, что Ag 3d и Cl 2p в композите CeO₂/AgCl -30 сдвигаются в сторону увеличения энергии связи по сравнению с чистым AgCl . Это объясняется тем, что после загрузки CeO₂ на AgCl плотность электронного облака вокруг Ag⁺ и Cl⁻ уменьшается, и притяжение ядра к внешним электронам усиливается, что и приводит к смещению энергии связи в сторону увеличения [21,22].
- Рисунок 2C: спектр O 1s показывает два пика. Для CeO₂ пик на 528,9 эВ относится к связи Ce–O, а пик на 531,6 эВ обусловлен поверхностно-адсорбированным кислородом [23]. В CeO₂/AgCl -30 соответствующие пики наблюдаются на 528,7 эВ и 531,2 эВ.
- Рисунок 2D: в спектре Ce 3d пики на 897,6 эВ и 916,2 эВ в CeO₂ соответствуют Ce⁴⁺ 3d₅/₂ и Ce⁴⁺ 3d₃/₂, а в CeO₂ /AgCl -30 — 897,3 эВ и 915,6 эВ. Также пики Ce³⁺ 3d₅/₂ и Ce³⁺ 3d₃/₂ в CeO₂ находятся на 882,3 эВ и 887,8 эВ, а также 900,4 эВ и 906,6 эВ [24,25]; в композите CeO₂/AgCl -30 — 881,9 эВ, 887,2 эВ, 900,2 эВ и 906,4 эВ соответственно.
При сравнении изменений в энергиях связи O 1s и Ce 3d в CeO₂ и CeO₂ /AgCl -30 наблюдается смещение в сторону понижения энергии связи, что резонирует с аналогичным смещением в спектрах Ag 3d и Cl 2p.
Таким образом, на основе наблюдаемых изменений энергий связи в анализе XPS, можно заключить, что между CeO₂ и AgCl в композите образуется S-схема гетеростыка с наличием химической связи между компонентами.
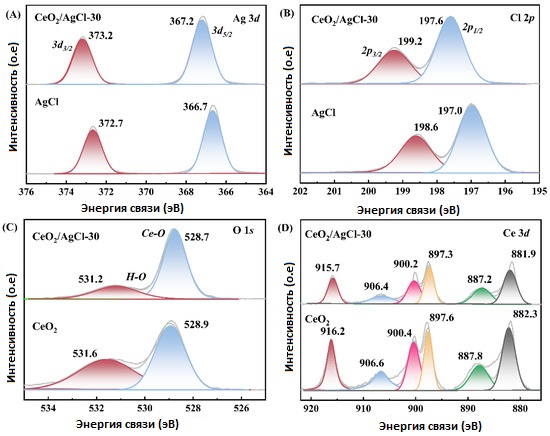
Рисунок 2. XPS-спектры AgCl , CeO₂ и CeO₂ /AgCl -30: (A) Ag 3d, (B) Cl 2p, (C) O 1s и (D) Ce 3d.
Морфология AgCl , CeO₂ и CeO₂ /AgCl -30 была исследована с помощью сканирующей электронной микроскопии (SEM). Как показано на Рисунке 3A, AgCl представляет собой относительно крупные гранулированные частицы с гладкой поверхностью. Для сравнения, на Рисунке 3B видно, что CeO₂ состоит из наночастиц с относительно небольшими размерами.
В процессе синтеза вышеуказанного композитного материала CeO₂ /AgCl нитрат серебра (AgNO₃) и соляная кислота (HCl) взаимодействуют с CeO₂ , выступающим в роли ядра, и формируют оболочку из AgCl . Затем, благодаря свойству AgCl легко фотораспадаться, на поверхности композита образуются наночастицы серебра, как показано на Рисунках 3C и 3D.
В композите CeO₂ /AgCl -30 CeO₂ и AgCl формируют структуру ядро–оболочка, устанавливая тесный межфазный контакт. При этом наблюдается эффект поверхностного плазмонного резонанса (SPR), связанный с Ag-частицами на поверхности. Этот эффект может способствовать ускоренной передаче фотогенерированных электронов и улучшать фотокаталитическую эффективность композитного материала [26].

Рисунок 3. SEM-изображения: (A) AgCl , (B) CeO₂ и (C), (D) CeO₂ /AgCl -30.
Одновременно распределение элементов в образце CeO₂ /AgCl -30 было исследовано на Рисунке S2, где можно наблюдать сигналы элементов Ag, Cl, O и Ce. Следует отметить, что сигналы O и Ce в картах распределения EDS и диаграммах элементного состава выражены слабо, что дополнительно подтверждает, что CeO₂ , как ядро композитного материала, инкапсулирован AgCl . Сравнительно более сильный сигнал Ag также указывает на то, что наночастицы серебра находятся на поверхности композита [27].
Оптические свойства AgCl , CeO₂ и композитов CeO₂ /AgCl с различными соотношениями были исследованы методом диффузной отражательной спектроскопии в ультрафиолетово-видимом диапазоне (см. Рисунок 4A). По сравнению с чистым AgCl
,светопоглощение композитов CeO₂ /AgCl значительно усилилось. Наблюдается усиленное поглощение в сторону длинноволновой области, что подтверждает феномен красного смещения [28,29].
Феномен красного смещения, наблюдаемый в спектрах нанокомпозитов, указывает на формирование S-схемной гетероструктуры между CeO₂ и AgCl через химические связи [30]. При этом также наблюдается неструктурированное растяжение в области видимого света, что связано с фоторазложением AgCl до Ag [31,32], как показано в следующем уравнении:
2AgCl→h𝑣2Ag+Cl2
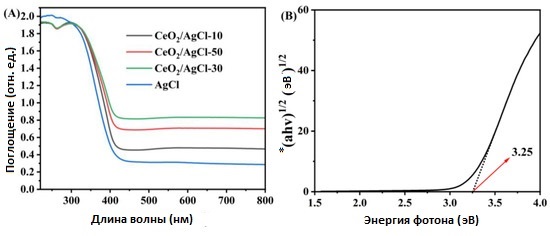
Рисунок 4. (A) УФ-видимая диффузно отражательная спектроскопия для AgCl и композитов с разными пропорциями и (B) ширина запрещённой зоны AgCl .
*произведение коэффициента поглощения и энергии фотона
Было обнаружено, что по сравнению с чистым AgCl композитный материал демонстрирует слабую широкую полосу поглощения, которая связана с резонансом поверхностного плазмона (SPR) серебряных наночастиц [33,34]. Этот результат дополнительно подтверждает образование металлических серебряных видов в процессе синтеза композитного материала. На рисунке 4B ширина запрещённой зоны (Eg) AgCl была рассчитана примерно как 3.25 эВ с использованием формулы Кубельки-Мунка [35,36], также были рассчитаны ширины запрещённой зоны CeO2 и композитного материала CeO₂ /AgCl -30, которые составили соответственно 3.15 эВ (рисунок S3B) и 3.19 эВ (рисунок S3C).
Для изучения эффективности разделения зарядов в чистом AgCl и композитах был проведён тест фотолюминесцентного (PL) спектра для характеристики радиационной рекомбинации зарядов. На рисунке 5 можно наблюдать два сильных пиковых поглощения при 481 нм и 435 нм. Пик при 481 нм можно отнести к PL сигналу, связанному с комплексными дефектами Ag+-Ag0, возникающими при фотодекомпозиции AgCl и эффектом SPR образованного Ag0 [37]. Между тем, пик при 435 нм может быть связан с центрами поглощения около вакансий Cl− [38]. Для композитных материалов с разными пропорциями интенсивности пиков уменьшались в разной степени. Среди них CeO₂ /AgCl -30 показал самый низкий PL сигнал, что указывает на наивысшую эффективность разделения пар электрон–дырка (e−-h+). В частности, интенсивность эмиссионного пика уменьшается после объединения CeO₂ с AgCl в композитный материал. Это явление можно объяснить образованием гетероперехода по схеме S (S-scheme heterojunction), проходящего через CeO₂ и AgCl , который способен подавлять рекомбинацию фотогенерированных дырок (h+) и электронов (e−) [39,40].
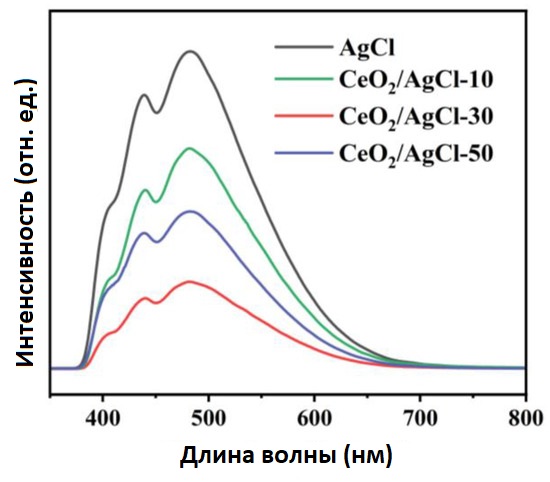
Рисунок 5. Фотолюминесцентные спектры AgCl и CeO₂ /AgCl -30.
Плотность фототока может напрямую отражать характеристики переноса фотогенерированных электронов. Чем выше плотность фототока, тем выше эффективность разделения фотогенерированных носителей заряда [41]. Амплитуды переходных фототоков в чистом AgCl , а также в композитных материалах CeO₂ /AgCl с разными соотношениями были измерены в циклах включения и выключения освещения; результаты представлены на рисунке 6A. Все образцы генерировали фототок при облучении видимым светом, что говорит о способности создавать электроны и дырки. В то же время, CeO₂ /AgCl -30 показал наибольшую интенсивность фототока, демонстрируя лучшую эффективность разделения пар электрон–дырка.
Стоит отметить, что после включения света фототок композитного материала показывает непрерывный рост. Это может объясняться динамическим процессом, при котором AgCl непрерывно разлагается на наночастицы Ag под воздействием света. Новообразованные наночастицы Ag благодаря эффекту SPR формируют более эффективный перенос зарядов, что приводит к постоянному увеличению фототока [42].
Кроме того, при увеличении доли AgCl в композите возникает сильное агломерирование, что снижает количество активных серебряных частиц. Это препятствует переносу электронов и ослабляет эффект SPR. Поэтому интенсивность фототока образца CeO₂ /AgCl -50 значительно снижается.
Для дальнейшего изучения способности переноса зарядов при облучении видимым светом была проведена электрохимическая импедансная спектроскопия (EIS). Широко известно, что меньший радиус дуги на спектре EIS свидетельствует о более высокой эффективности разделения зарядов [43,44]. На рисунке 6B порядок размеров радиусов дуг для образцов следующий: AgCl > CeO₂ /AgCl -10 > CeO₂ /AgCl -50 > CeO₂ /AgCl -30. Очевидно, что образец CeO₂ /AgCl -30 демонстрирует наименьший радиус дуги, что означает минимальное сопротивление переносу зарядов и дополнительно подтверждает формирование гетероперехода по схеме S между CeO₂ и AgCl , способствующего миграции электронов, что совпадает с результатами рентгеновской фотоэлектронной спектроскопии (XPS), представленными в этой статье.
Низкое сопротивление указывает на лучшую эффективность переноса фотогенерированных пар электрон–дырка, что также подтверждает вышеупомянутый эффект SPR.
Диаграммы EIS для лучших образцов — CeO₂ /AgCl -30 и AgCl — были подогнаны под соответствующие эквивалентные схемы с помощью программы Zview, данные приведены в таблице S1. Предложенная модель эквивалентной схемы (рисунок S4) состоит из четырёх последовательных компонентов: постоянного резистора Rs и двух резисторов R1 и R2, параллельно соединённых с элементами постоянной фазы (CPE1, CPE2). Результаты показывают, что сопротивление переносу зарядов для CeO₂ /AgCl -30 значительно ниже, чем у AgCl , что свидетельствует о значительном улучшении электрохимических характеристик. Образец эффективно разделяет пары e−–h+ под световым облучением и способствует переносу зарядов.
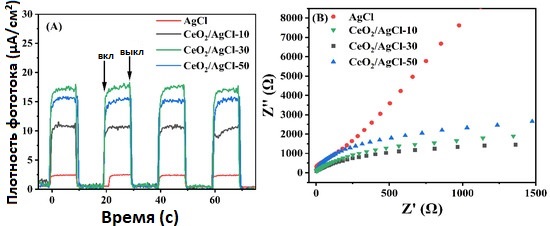
Рисунок 6. (A) Переходные характеристики фототока и (B) электрохимическая импедансная спектроскопия (EIS) для AgCl и композитов с разными пропорциями.
Фотокаталитическую активность AgCl и композитных материалов CeO₂ /AgCl исследовали на примере разложения родамин B (RhB). В кислых условиях большое количество ионов водорода (H+) в растворе связывается с основными центрами, например, с атомами азота в молекулах родамина B, вызывая их протонирование. Протонированный родамин B несёт положительный заряд, увеличивая степень ионизации и повышая растворимость в воде. При повышении pH и увеличении щелочности концентрация гидроксид-ионов (OH−) в растворе растёт, и молекулы родамина B постепенно теряют протоны, снижая степень ионизации. Чтобы минимизировать экспериментальные помехи, для приготовления раствора RhB использовали нейтральную деионизированную воду.
На рисунке 7A показаны результаты тестирования фотокаталитической деградации чистого AgCl , CeO₂ и композитов CeO₂ /AgCl с разными соотношениями в растворе RhB концентрацией 10 мг/л. Видно, что при данных условиях чистый CeO₂ обладает относительно слабой деградационной активностью, а AgCl также не демонстрирует высокой фотокаталитической активности. Однако после введения CeO₂ в AgCl фотокаталитические свойства композитов значительно улучшились. При этом на рисунке 7B показано, что скорости деградации трёх композитных материалов существенно увеличились. Из них композит CeO₂ /AgCl -30 с загрузкой CeO₂ в 30% обладает наилучшей скоростью деградации — до 99%.
Стоит отметить, что оптимальная степень деградации не достигла 100%. Это может быть связано с погрешностями в экспериментальном оборудовании, а также с наличием динамического равновесия адсорбции и десорбции между материалом и красителем.
В процессе разложения молекул RhB супероксидные радикалы сначала атакуют сопряжённую хромофорную структуру RhB, например, добавляя двойные связи углерод–углерод, вызывая реакции раскрытия кольца. Этот процесс нарушает цветовую структуру, что приводит к постепенному выцветанию раствора RhB. Затем начинают действовать гидроксильные радикалы — сильные окислители без селективности. Они атакуют другие химические связи в молекулах RhB, например, удаляют атомы водорода из алкильной цепи, образуя алкильные группы, которые далее окисляются, постепенно превращая молекулы RhB в малые органические кислоты, альдегиды и другие промежуточные продукты. Одновременно озон окисляет уже образовавшиеся промежуточные продукты, способствуя их минерализации. По мере продолжения реакции эти промежуточные продукты полностью минерализуются в безвредные для окружающей среды малые молекулы, такие как углекислый газ (CO2) и вода (H2O).
На рисунке 7C показана кинетическая модель первого порядка, применимая к материалам, и рассчитана константа скорости K [45]. Значения K для AgCl , CeO₂ /AgCl -10, CeO₂ /AgCl -30, CeO₂ /AgCl -50 и CeO₂ составляют 0.012, 0.067, 0.11, 0.084 и 0.0073 мин−¹ соответственно. Значение K для CeO₂ /AgCl -30 самое высокое — оно превышает показатель чистого AgCl в 9.17 раза.
Стоит отметить, что УФ-видимая спектроскопия может использоваться для изучения обесцвечивания растворов органических красителей. Однако из-за образования большого количества побочных продуктов в процессе фотокаталитического разложения она не может однозначно подтвердить полное разрушение красителей. В отличие от этого, анализ общего органического углерода (TOC) является эффективным методом оценки степени разложения органических красителей.
На рисунке 7D показаны показатели удаления TOC для RhB после 60 минут светового облучения с использованием разных фотокатализаторов. Видно, что для пяти образцов AgCl , CeO₂ , CeO₂ /AgCl -10, CeO₂ /AgCl -30 и CeO₂ /AgCl -50 показатели удаления TOC составляют 13%, 5%, 42%, 61% и 50% соответственно. Этот результат дополнительно подтверждает, что синтезированный композит CeO₂ /AgCl -30 является высокоэффективным фотокатализатором для разложения органических красителей.
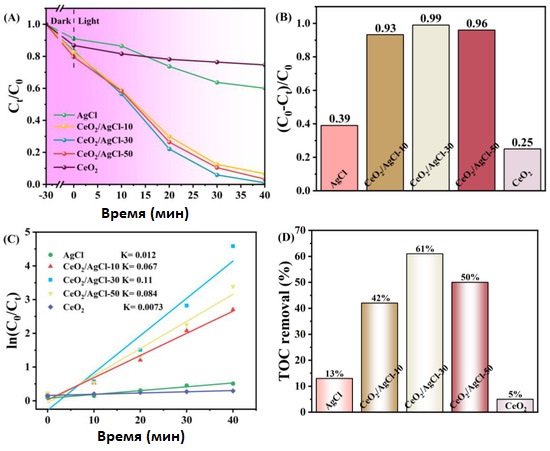
Рисунок 7. (A) Кривые фотодеградации RhB под видимым светом, (B) скорость деградации, (C) кинетические кривые первого порядка для AgCl , CeO₂ и композитов с разными пропорциями, и (D) удаление общего органического углерода (TOC) из раствора красителя с использованием разных фотокатализаторов после 60 минут облучения.
Для проверки стабильности работы образца CeO₂ /AgCl -30 были проведены четыре цикла деградационных испытаний, результаты которых представлены на рисунке 8A. После четырёх циклов деградации фотокаталитическая активность материала немного снизилась, однако всё ещё оставалась достаточно высокой.
Далее были проведены анализы XRD и FTIR для образцов после циклов. Было установлено, что по сравнению с исходными свежими образцами до реакции значительных изменений в сигналах не наблюдается. Кроме того, в сочетании с изображениями SEM образцов после циклов, показанными на рисунке 8D, можно сделать вывод, что химическая структура и поверхностные характеристики образцов после циклов не претерпели существенных изменений.
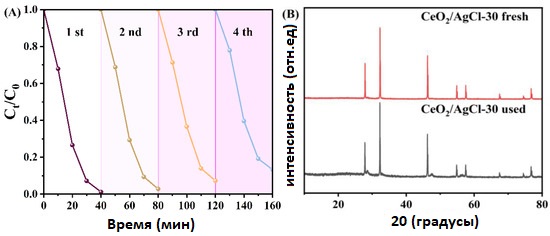
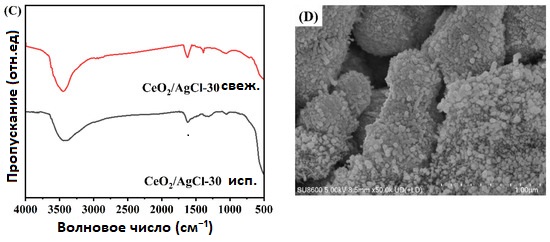
Рисунок 8. (A) Циклические эксперименты по фотодеградации RhB с использованием CeO₂ /AgCl -30, (B) рентгеновские дифрактограммы (XRD), (C) Фурье-спектры (FTIR) композита CeO₂ /AgCl-30 до и после фотодеградации RhB, и (D) изображение с помощью сканирующей электронной микроскопии (SEM) образца CeO2/AgCl -30.
Для проверки, сможет ли приготовленный в данной работе композит CeO₂ /AgCl сохранить отличные характеристики в различных условиях, был приготовлен раствор RhB концентрацией 10 мг/л на основе морской воды для имитации морской среды. В качестве представительного образца для фотокаталитического разложения был выбран CeO₂ /AgCl-30. Аналогично, как видно на рисунке 9A, по сравнению с CeO₂ и AgCl композит CeO₂ /AgCl-30 по-прежнему демонстрирует отличные показатели деградации. Из рисунка 9B видно, что скорость деградации для CeO₂ /AgCl-30 достигает 96%. Исходя из вышеуказанных результатов, можно сделать вывод, что катализатор CeO₂ /AgCl способен эффективно разлагать загрязнители в различных средах, одновременно сохраняя высокую эффективность деградации.
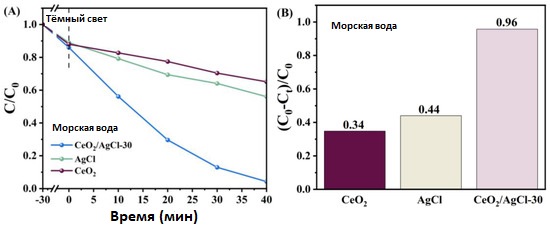
Рисунок 9. (A) Кривые фотодеградации и (B) скорость деградации RhB под видимым светом в среде морской воды.
Для определения, проявляет ли композит CeO₂ /AgCl фотокаталитическую активность по отношению к другим загрязнителям, были также исследованы свойства фотокаталитического разложения AgCl, CeO₂ и композита CeO₂ /AgCl на примерах метилового оранжевого (рисунки 10A, B) и кристаллического фиолетового (рисунки 10C, D). При одинаковых условиях CeO₂ /AgCl-30 продолжал демонстрировать выдающиеся результаты фотокаталитической деградации. На рисунках 10A и 10C чётко видно, что эффективность CeO₂ /AgCl-30 значительно превосходит AgCl. Кроме того, скорость деградации CeO₂ /AgCl-30 для метилового оранжевого (рисунок 10B) и кристаллического фиолетового (рисунок 10D) достигла 82% и 88% соответственно.
Сравнение эффективности деградации образцов по отношению к вышеупомянутым моделируемым загрязнителям свидетельствует, что композит CeO₂ /AgCl-30 способен сохранять высокую эффективность для различных загрязнителей и обладает большим потенциалом в области фотокаталитического разложения.
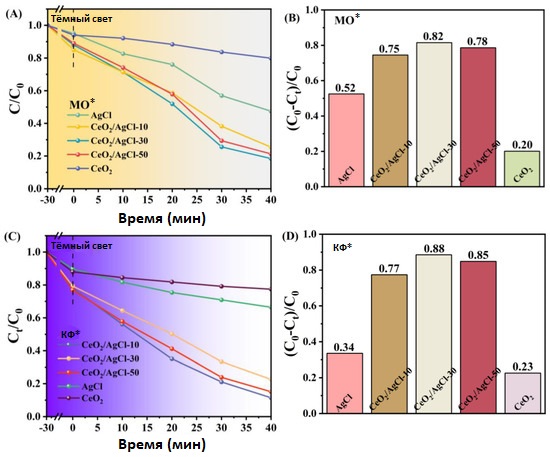
Рисунок 10. (A) Кривые деградации, (B) скорость деградации *метилового оранжевого (MO), (C) кривые деградации, и (D) скорость деградации *кристаллического фиолетового (КФ) для AgCl, CeO₂ и композитов с разными пропорциями.
Реактивные виды, играющие главную роль в процессе деградации, были определены с помощью добавления различных поглотителей (скэвенджеров). Динатриевая соль этилендиаминтетрауксусной кислоты (EDTA), аскорбиновая кислота, метанол и диметилсульфоксид использовались для захвата h+, ·O2−, ·OH и e− соответственно [46,47,48,49].
На рисунке 11, на примере деградации RhB, видно, что четыре вещества играли разную степень важности в реакции. Особенно заметно, что по сравнению с контрольным опытом (без добавок), после введения аскорбиновой кислоты (AA) скорость деградации резко снизилась с 99% до 39%, а при добавлении метанола (MeOH) — до 51%, что доказывает, что основными реактивными видами являются супероксид-радикал (·O2−) и гидроксильный радикал (·OH). В то же время, после поглощения h+ и e− скорость деградации снизилась до 71% и 84% соответственно, что свидетельствует о второстепенной роли этих видов в процессе деградации.
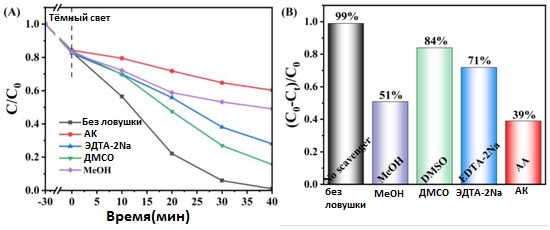
Рисунок 11. Определение активных видов с помощью захвата на композите CeO₂ /AgCl-30: (A) кривые деградации, (B) скорость деградации.
Для дальнейшей проверки, что в процессе фотокаталитического разложения CeO₂ /AgCl образуются значительные количества ·O2− и ·OH, был проведён электронный парамагнитный резонанс (ESR) с использованием DMPO в качестве ловушки радикалов. В качестве примера для теста был выбран композит CeO₂ /AgCl-30.
Как видно на рисунках 12A и 12B, при реакции в темноте не было обнаружено сигналов, указывающих на образование свободных радикалов. Однако после десяти минут облучения были зафиксированы чёткие сигналы ·O2− и ·OH. Это подтверждает, что композит CeO₂ /AgCl способен генерировать большое количество радикалов ·O2− и ·OH при освещении [50,51].
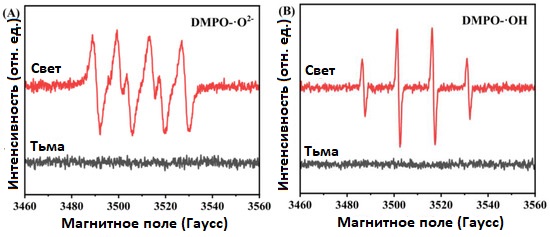
Рисунок 12. (A) DMPO-·O2− и (B) DMPO-·OH ESR спектроскопия захвата спинов для композита CeO₂ /AgCl-30.
Поскольку активность фотокатализаторов связана с их типом полупроводника, зоной проводимости (CB) и валентной зоной (VB), метод измерения Мотта–Шоттки используется для определения потенциалов зон и типа полупроводника. На рисунке S5 показаны Мотт–Шоттки графики для чистого AgCl и CeO₂ , измеренные при частотах 1000, 1500 и 2000 Гц соответственно. Наклоны касательных во всех случаях положительны, что указывает на то, что и AgCl, и CeO₂ являются полупроводниками n-типа [52].
Пересечения кривых Мотт–Шоттки с осью абсцисс соответствуют плоскому уровню Ферми (EFB). Значения EFB для AgCl и CeO₂ относительно электрода Ag/AgCl составляют −0.21 и −1.59 В (VSCE) соответственно. Для полупроводников n-типа зона проводимости (CB) расположена примерно на 0.1 В более отрицательно по сравнению с EFB. Используя формулу ENHE = EAg/AgCl + 0.198 В [53], получаем значения ECB относительно нормального водородного электрода (NHE): −0.112 В и −1.492 В.
Согласно уравнению EVB = ECB + Eg [54], потенциалы валентной зоны (VB) для AgCl и CeO₂ равны 3.138 В и 1.658 В (VNHE) соответственно.
Электронная зонная структура CeO₂ до контакта с AgCl показана на рисунке 13A. Обычно для формирования гетероперехода по схеме S уровень Ферми (EF) и зона проводимости (CB) восстановительного полупроводника CeO₂ находятся выше, чем у окислительного полупроводника AgCl.
При контакте из-за различий в распределении электронной плотности в объёмах и на интерфейсах CeO₂ и AgCl уровни EF в CeO2 и AgCl расходятся (рисунок 13B). У интерфейса AgCl происходит увеличение электронной плотности и повышение EF, а у интерфейса CeO₂ — снижение электронной плотности и понижение EF. В результате края зон CeO₂ и AgCl изгибаются в зоне интерфейса, формируя встроенное электрическое поле [55].
Как показано на рисунке 13C, при энергии падающего света, превышающей ширину запрещённой зоны обоих материалов, электроны валентной зоны (VB) возбуждаются в зону проводимости (CB). Потенциал валентной зоны CeO₂ равен 1.658 В, что более отрицательно по сравнению с потенциалом пары ·OH/H2O (2.40 В), поэтому генерация ·OH затруднена [56]. Потенциал валентной зоны AgCl равен 3.138 В — значительно выше потенциала ·OH/H2O (2.40 В). Следовательно, вода (H2O) может окисляться до ·OH фотогенерированными дырками (h+) в валентной зоне AgCl, и ·OH эффективно разлагает RhB.
Однако потенциал зоны проводимости AgCl (−0.112 В) выше потенциала пары O2/·O2− (−0.33 В), поэтому O2 не может быть восстановлен электронами из зоны проводимости AgCl в радикалы ·O2−, что серьёзно ограничивает фотокаталитическую активность AgCl.
Поэтому эффективность фотокаталитического разложения RhB чистым CeO₂ или AgCl довольно низкая.
После формирования гетероперехода по схеме S между CeO₂ и AgCl фотогенерированные электроны из зоны проводимости AgCl рекомбинируют с дырками валентной зоны CeO₂ на интерфейсе, сохраняя электроны в зоне проводимости CeO₂ и дырки в валентной зоне AgCl с сильными восстановительными и окислительными свойствами.
CeO₂ имеет относительно отрицательный потенциал зоны проводимости (−1.492 В), поэтому электроны в CB CeO₂ могут восстанавливать адсорбированный O2 с образованием радикалов ·O2−.
AgCl имеет относительно положительный потенциал валентной зоны (+3.138 В), что позволяет дыркам (h+) с высокой окислительной способностью в VB AgCl окислять воду с образованием ·OH.
И ·O2−, и ·OH способствуют разложению RhB, а дырки (h+) валентной зоны AgCl могут также непосредственно разлагать молекулы RhB [57].
Кроме того, из-за фотодиссоциации AgCl на поверхности образуется серебро. Наночастицы серебра могут возбуждаться через эффект поверхностного плазмонного резонанса (SPR), генерируя электроны и дырки [58].
С одной стороны, возбуждённые электроны могут переноситься в зону проводимости CeO₂ , способствуя генерации супероксидных радикалов. С другой стороны, дырки, образующиеся на наночастицах Ag, могут переноситься на поверхность AgCl.
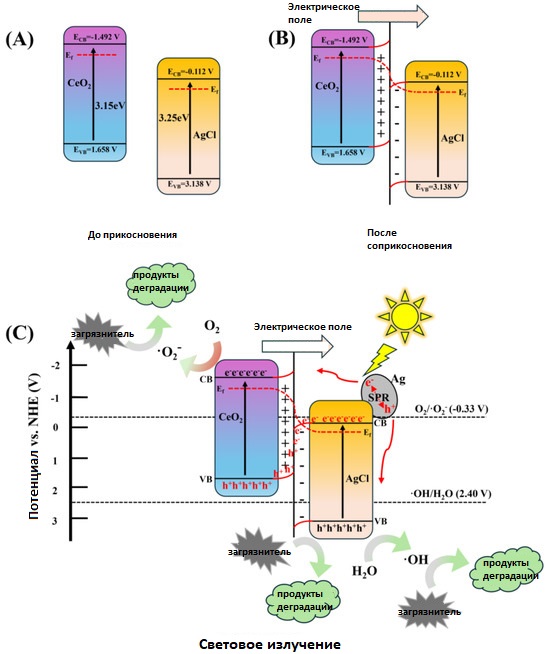
Рисунок 13. (A) Края зон CeO₂ и AgCl до контакта, (B) внутреннее электрическое поле и изгиб краёв зон на интерфейсе CeO₂ /AgCl после контакта, и (C) механизм переноса зарядов по схеме S между CeO₂ и AgCl под световым облучением.
Благодаря описанным выше механизмам в композитном материале эффективно разделяются электроны и дырки, а также образуется больше реактивных форм кислорода. Это способствует повышению фотокаталитической активности композита CeO₂ /AgCl.
Наконец, на рисунке 14 показаны возможные промежуточные продукты и конечные продукты деградации RhB на композитном материале CeO₂ /AgCl-30 в процессе фотокатализа. Согласно предыдущим публикациям [4,59], фотокаталитический процесс разложения RhB включает четыре основных этапа: N-дезалкилирование, разрыв хромофорной группы, раскрытие кольца и минерализацию. Конечными продуктами разложения являются CO2 и H2O.
В нашем процессе фотокаталитического разложения также не были обнаружены заметные органические соединения, что указывает на то, что конечными продуктами разложения RhB являются углекислый газ и вода.
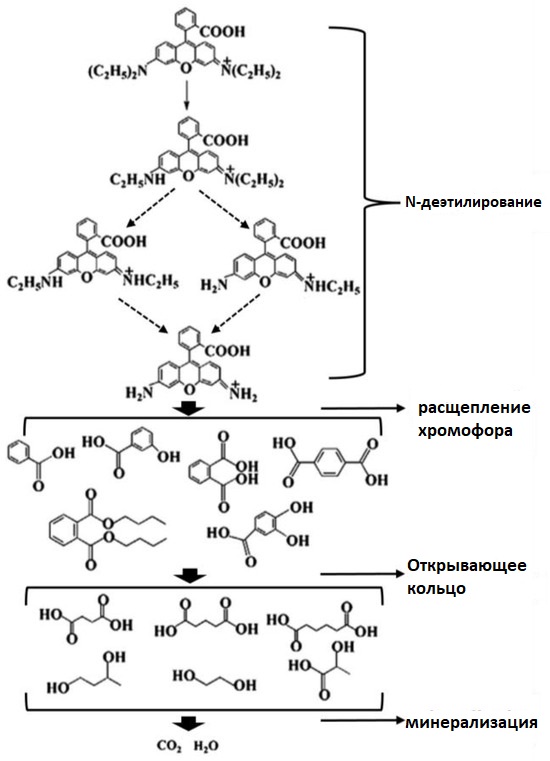
Рисунок 14. Возможные промежуточные продукты деградации и конечные продукты разложения RhB на композите CeO₂ /AgCl-30.
- Заключение
Был успешно синтезирован новый фотокатализатор CeO₂ /AgCl методом одноступенчатого химического осаждения. Комбинирование CeO₂ с AgCl для создания гетероперехода по схеме S позволяет эффективно подавлять рекомбинацию фотогенерированных электронов и дырок, снижать сопротивление переносу зарядов и повышать фотокаталитическую активность. Фотокаталитическая деградация различных органических загрязнителей композитом CeO₂ /AgCl превосходит чистый AgCl. Максимальная скорость деградации достигает 99% за 40 минут и при этом не зависит от изменений окружающей среды.
Эксперименты подтвердили, что ключевыми реактивными видами являются радикалы ·O2− и ·OH, которые эффективно разлагают органические красители и в итоге превращают их в малые молекулы, не вредящие окружающей среде. Стабильность фотокаталитической активности была доказана в ходе четырёх циклов испытаний, а также с помощью анализа XRD, FTIR и SEM, что имеет большое значение для практического применения материалов.
Данные результаты демонстрируют потенциал применения CeO₂ /AgCl в очистке воды, проясняют особенности подготовки высокоэффективных фотокатализаторов и могут способствовать решению проблемы деградации загрязнителей. Это расширяет область применения фотокаталитических технологий в сфере экологической очистки. Кроме того, более глубокое понимание механизма взаимодействия между CeO₂ и AgCl, а также механизма фотокаталитической деградации RhB обогащает теоретические знания в области фотокатализа.