Синтез золотых нанопроводов с использованием полупогружённых нанопористых шаблонов из анодного оксида алюминия в электролите калий дицианоаурат–гексацианоферрата
1. Введение
Золотые нанопроводы представляют интерес для самых разных направлений нанонауки и разработки наносенсоров. Они обладают высокой электрической проводимостью и химической инертностью. Сфера их применения включает биосенсоры, наноэлектронику и плазмонные устройства . Существует несколько методов синтеза нанопроводов, таких как литография, фотохимический синтез, химическое восстановление и электрохимическое осаждение .
До недавнего времени золотые нанопроводы успешно получали из электролитов, содержащих цианиды, сульфиты и другие коррозионно-активные или выделяющие вредные газы вещества. В ряде случаев электролиты также включали тяжёлые металлы (Co, Ni, Cu). В нескольких работах показано, что Au можно осаждать из безцианидных растворов, однако такие исследования встречаются редко. Электролиты на основе золот(І) сульфата и золот(І) тиосульфата имеют низкую стабильность соединений, что затрудняет их применение. Ауроорганические комплексы более стабильны, но при этом нередко отмечают проблемы с качеством покрытия (его ровностью и толщиной).
Ещё одним электролитом для синтеза золотых нанопроводов является калий дицианоаурат–гексацианоферрат, известный как золочильный электролит. В отличие от других цианидсодержащих систем, этот электролит более безопасен, поскольку при осаждении нанопроводов не образуются вредные газы. Его компоненты устойчивы в слабокислой и нейтральной среде, что позволяет применять карбонат натрия для нейтрализации освобождающихся ионов цианида.
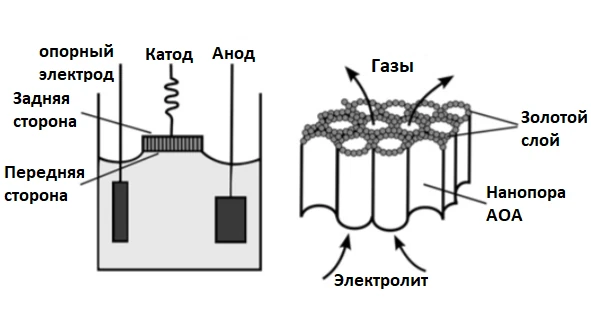
Классические методы электрохимического изготовления металлических нанопроводов предусматривают полное погружение электродов в раствор электролита. Для контроля направления движения ионов металл-анион при этом обратную сторону пористого материала (например, анодного оксида алюминия, АОА) защищают непроводящим материалом. Такие поры обычно заполнены воздухом или газами, образующимися при электролизе воды или «индифферентных» компонентов электролита, что может препятствовать диффузии ионов внутрь пор. Для удаления газов используют подключение ячейки к вакууму; особенно важно удалять воздух при начальной стадии роста нанопроводов.
В настоящем письме мы демонстрируем успешное применение калий дицианоаурат–гексацианоферратного электролита для получения золотых нанопроводов. Мы изучили реакцию синтеза этого электролита и адаптировали метод для осаждения нанопроводов. Ключевым усовершенствованием стал способ размещения пористого шаблона АОА на поверхности электролита вместо его полного погружения. Таким образом обратная сторона оксида алюминия с тонким слоем благородного металла защищена от прямого контакта с раствором без применения герметиков, плёнок или непроводящих клеев, которые могут загрязнять электролит и саму структуру нанопроводов. Мы называем этот подход «шаблон полупогружённого типа» (semi-immersed template).
2. Экспериментальная часть
2.1. Приготовление электролита на основе калий дицианоаурат–гексацианоферрата
В методику, описанную в литературе [19, 20], введены следующие уточнения: соотношение компонентов, значение pH и порядок смешивания. В 0,2 M раствор хлорауриевой кислоты постепенно добавляли в 0,2 M раствор калий гексацианоферрата(II) до прекращения образования синеватого осадка железа(III) гексацианоферрата(II) (реакции (1) и (2)). Затем раствор нагревали до 80 °C для снижения концентрации синильной кислоты и после этого охлаждали до комнатной температуры. Раствор доводили до pH 5–7 карбонатом калия. После отстаивания светло-зелёно-жёлтый слой электролита калий дицианоаурат–гексацианоферрата отделяли и использовали в экспериментах. Концентрация золота в готовом электролите составляла 1–4 г Au/л. УФ-спектры реагентов и продуктов измеряли на УФ/ВИ-спектрофотометре.
4 H[AuCl4]III + 9 K4Fe(CN)6II → 4 K[Au(CN)2]I + Fe4[Fe(CN)6]3III + 2 K3[Fe(CN)6]III + 16 KCl + 10 KCN + 4 HCN
(1)
6 H[AuCl4] + 7 K4Fe(CN)6 → 6 K[Au(CN)2] + Fe4[Fe(CN)6]3 + 22 KCl + 2 HCl + 2 H2
(2)
Качество электролита проверяли двумя методами: отложением массы золота на пластинчатом электроде при постоянном напряжении 2 В (токовая плотность 11–14 мА/см²) и циклической вольтамперометрией (сканирование от –1,3 В до +1,3 В, шаг 0,0024 В, скорость 0,09 В/с) на потенциостате Autolab PGSTAT30 с каломельным калибровочным электродом.
2.2. Синтез золотых нанопроводов
В экспериментах использовали АОА-шаблоны (АОА, ANOPORE, SPI Supplies) толщиной 45–60 µm с поровым диаметром 100 nm. Шаблоны обрабатывали 0,5 M ортофосфорной кислотой при 20–25 °C в течение 70 мин для удаления барьерного слоя и расширения пор (диаметр увеличивался до ∼150 nm). Затем обратную сторону шаблона покрывали золотом (50–100 nm) в установке Gatan 682; толщина золотого слоя составляла 5–50 % от диаметра пор, чтобы торцы пор оставались открытыми.
АОА-золото использовали в качестве катода, платиновый электрод — анода, Ag/AgCl — опорного электрода. Шаблон помещали на поверхность электролита так, чтобы мениск между электролитом и АОА образовался за счёт баланса силы пружины платиновой проволоки (пружина приклеивалась к золотому слою проводящим клеем) и поверхностного натяжения. Оптимальная величина натяжения пружины составляла 5,4–5,6 мN/см².
Для сравнения нанопроводы также получали классическим методом полного погружения в электролит калий дицианоаурат–цитрат (по рецепту [5]: 25 mg K[Au(CN)₂], 730 mg динатрийцитрата, 236 mg сукциновой кислоты, 45 mg оксаловой кислоты дигидрата и 384 mg лимонной кислоты, каждый компонент растворяли в 1 ml воды и смешивали). Перед синтезом шаблоны изолировали парафильмом или непроводящим клеем и откачивали из пор воздух вакуум-насосом до исчезновения пузырьков.
Рост нанопроводов в обоих случаях контролировали потенциостатом Autolab PGSTAT30. В течение первых 5–7 с приложенное напряжение было –0,9 В (ток –1…–2 мА), далее рабочее напряжение снижалось до –1,2 В (токовая плотность –4…–5 мА/см²), общее время электролиза — 3 ч; раствор помешивали и поддерживали температуру 40–50 °C.
Для оценки заполнения пор АОА растворяли в 0,5 M ортофосфорной кислоте в течение 10–15 мин со стороны фронта шаблона [26, 27]. Остатки золота и мембраны снимали Ar-ионным травлением (энергия 9,5 keV, ток 600–614 µA, угол 22,5–45°, вращение образца) в системе Gatan. Полученные нанопроводы исследовали на просвечивающем SEM Hitachi S-4800 с ЭДС-анализатором Quanta XFlash 5010.
3. Результаты и обсуждение
3.1. Анализ электролита калий дицианоаурат–гексацианоферрата
На рис. 2 a приведены УФ-спектры реагентов и продуктов реакции синтеза электролита. Реагенты поглощают УФ-свет с максимумами абсорбции: H[AuCl₄] – при 287 нм и K₄[Fe(CN)₆] – при 325 нм. В ходе реакций (1) и (2), при смешении этих компонентов, Au(III) из H[AuCl₄] восстанавливается до Au(I) и образует комплекс K[Au(CN)₂] с плато абсорбции от 200 до 250 нм. Одновременно Fe(II) из K₄[Fe(CN)₆] окисляется до Fe(III) и формирует K₃[Fe(CN)₆], у которого максимумы абсорбции лежат на 260 и 306 нм. Полученные спектры полностью совпадают с данными литературы [28–31] и подтверждают протекание синтеза электролита по уравнениям (1) и (2).
На рис. 2 b показаны изменения УФ-абсорбции самого электролита в процессе синтеза золотых нанопроводов. Изначально видны максимум при 306 нм и плато 200–250 нм, соответствующие K₃[Fe(CN)₆] и K[Au(CN)₂]. После осаждения золота плато расширяется до 200–260 нм, а также появляется новый максимум при 325 нм, совпадающий с УФ-спектром K₄[Fe(CN)₆]. Это свидетельствует о восстановлении Fe(III) в K₃[Fe(CN)₆] до Fe(II) в K₄[Fe(CN)₆] в процессе электроосаждения золота.
Рис. 2 a и 2 b демонстрируют циклические вольтамперограммы электролита калий дицианоаурат–гексацианоферрата. Золото начинает депонироваться на катоде при потенциале ε = –0,61 В согласно уравнению (3) [19, 32].
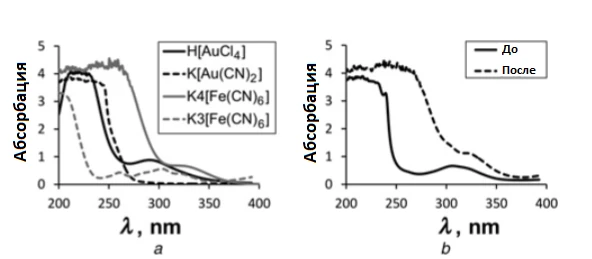
a) Компоненты реакции синтеза
b) Электролит до и после синтеза золотых нанопроводов
[Au(CN)2]– + e– → Au0 + 2 CN– (3)
Потенциал разложения составил –U₀ = –1,75 В, а превышение потенциала разряда кислорода на аноде (ηₐₙ,₀) было всего 0,09 В. Оба максимума при –0,37 В и +0,37 В связаны с изменением степени окисления железа в молекуле гексацианоферрата, как это показано в уравнении (4) [19, 33]:
[Fe(CN)6]3− + e− → [Fe(CN)6]4− (4)
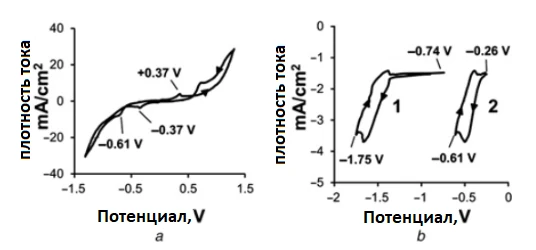
a) Полное электрохимическое окно
b) Электрохимическое окно для отрицательных потенциалов: 1 – циклограмма потенциала катода; 2 – циклограмма потенциала разложения
3.2. Сравнение золотых нанопроводов, полученных разными методами заполнения
Для сравнения классической электрохимической ячейки и ячейки с полупогружённым шаблоном АОА нанопроводы золота синтезировали из электролита калий дицианоаурат–цитрат. Поперечное сечение АОА-шаблона с нанопроводами, полученными полупогружённым методом, показано на рис. 4 a, b. В этом случае длина нанопроводов достигала 60 мкм, полностью проходя через толщу шаблона менее чем за 3 ч. Напротив, при полном погружении шаблона в электролит за те же 3 ч длина осаждённых нанопроводов ограничивалась примерно 3 мкм (рис. 4 c, d). Условия эксперимента были идентичны, за исключением способа погружения шаблона. В обоих случаях диаметр нанопроводов составлял 100–150 нм, что определялось геометрией шаблона.

a, b – при использовании полупогружённого шаблона АОА;
c, d – при полном погружении шаблона АОА в электролит.
Более короткая длина нанопроводов при полном погружении объясняется герметизацией задней стороны мембраны: накопившиеся газы частично блокируют поры и затрудняют приток ионов золота в мембрану. Наблюдаемая плотность тока осаждения золота в полупогружённом шаблоне АОА оказалась выше, чем в классической ячейке (рис. 5). Начальный ток в первые секунды электролиза выше установившегося тока при оптимальном росте нанопроводов, поскольку на переходных поверхностях системы накапливается больший заряд.
При полупогружённом методе важно не блокировать концы пор золотым слоем: электролит смачивает поверхность АОА и быстро проникает через поры в золотое покрытие, вытесняя газ из пор. Таким образом устанавливается надёжный контакт между электролитом, золотым слоем и металлической проволокой. Если концы пор заблокированы, диффузия ионов металла в поры затрудняется, в системе возникают локальные области с высоким градиентом поля, и направление электроосаждения может измениться. При открытых концах пор газы свободно утекают в атмосферу, что снижает вероятность их блокировки, стабилизирует осаждение и позволяет поддерживать постоянную диффузию анионов из пор в объёмный раствор.
На рис. 6 представлено SEM-изображение золотых нанопроводов, полученных полупогружённым методом после растворения АОА. Нанопроводы расположены плотно, все поры заполнены. Хотя концы провода имеют неправильную (треугольную или многоугольную) форму, сами провода цилиндрические с малой вариацией диаметра по всей длине образца. Аналогичная упорядоченность наблюдалась и для нанопроводов, синтезированных при полном погружении шаблона в электролит.

На рис. 7а показано поперечное сечение АОА-шаблона с золотыми нанопроводами, полученными из электролита калий-дицианоаурат–гексацианоферрата методом полупогружённого шаблона. Длина нанопроводов достигала 60 мкм при диаметре 100–150 нм, что соответствует размеру используемых нанопор АОА. Нанопроводы, осаждённые из дицианоаурат–гексацианоферратного электролита, оказались более гладкими и однородными по сравнению с нанопроводами, полученными из дицианоаурат–цитратного электролита.
Химический элементный анализ методом ЭДС (рис. 7b) показал, что нанопроводы из золота (Au), осаждённые в порах полупогружённого шаблона, обладают высокой чистотой. Обнаружены лишь алюминий и кислород — следы остатков АОА-шаблона. Элементы электролита (Fe, K) и серебро от проводящего клея не определялись.

a) SEM-изображение
b) ЭДС-спектр
4. Заключение.
Предложена усовершенствованная конструкция электрохимической ячейки, в которой АОА-шаблон размещён на поверхности электролита. Ключевое преимущество нового дизайна — свободный выход газов через открытые торцы пор. При этом средняя длина нанопроводов составляет 30–60 мкм, что в 10–20 раз превышает длину проводов, получаемых методом полного погружения при тех же условиях электролиза. Метод устраняет необходимость герметизации обратной стороны шаблона, уменьшая риск загрязнения электролита и нанопроводов материалом изоляции. Золотые нанопроводы, полученные из калий-дицианоаурат–гексацианоферратного электролита, отличаются высокой чистотой, гладкостью и однородностью по сравнению с нанопроводами из дицианоаурат–цитратного раствора. Полученные структуры могут применяться в качестве электродов в трёхмерных наноэлектронных устройствах или миниатюрных электрических контактов для исследований биологических образцов, где нежелательно использование вакуумных методов (например, электронная литография).





